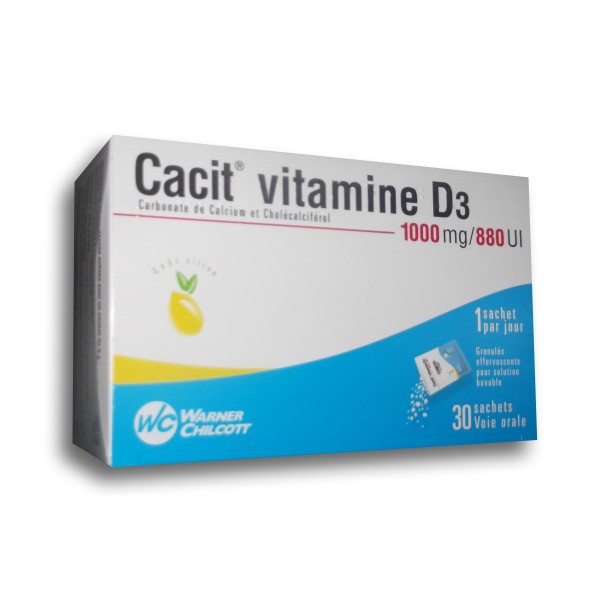
WARNER CHILCOTT
CACIT VITAMINE D3 1000mg – 30 sachets 8.0 g
EAN Ref. : 3400933878733
Produit en stock
CACIT VITAMINE D3 1000mg — 30 sachets renferme du calcium et de la vitamine D qui facilite l’absorption du calcium par l’intestin et sa fixation sur les os.
Prix : 6,31 €
A propos du produit
Des questions ? Vous souhaitez être conseillé ou vous voulez en savoir plus à propos du produit ?Appelez-nous au 01 45 75 33 35 Contactez-nous par mail
CACIT VITAMINE D3 1000mg — 30 sachets est un médicament du Laboratoire Warner Chilcott.
Il contient du calcium et de la vitamine D qui facilite l’absorption du calcium par l’intestin et sa fixation sur les os.
Il est utilisé :
— dans le traitement des carences en vitamine D et en calcium chez la personne âgée,
— dans le traitement d’appoint de l’ostéoporose lorsque l’apport conjoint de calcium et de vitamine D est nécessaire.
Posologie
Adulte : 1 sachet par jour.
Ce médicament doit être pris à distance de certains aliments (voir Interactions).
Le contenu des sachets doit être dissous dans un verre d’eau.
Composition
Calcium carbonate..........................................2,5 g
soit Calcium...............................................1 g
Colécalciférol (vitamine D3)...............................880 Ul
Substances actives : Calcium carbonate, Colécalciférol
Excipients communs : Acide citrique anhydre, Acide malique, Alpha-tocophérol, Amidon de maïs, D-gluconolactone, Gélatine, Glucose, Maltodextrine, Mannitol, Saccharose, Soja huile hydrogénée, Sorbitol
Autres excipients (spécifiques à certaines formes) : Abricot arôme, Acacia, Amidon de riz, Aspartam, Carmellose sodique, Cellulose microcristalline, Citron arôme, Citron essence, Dextrine, Gluconolactone, Gomme arabique, Magnésium stéarate, Potassium carbonate, Povidone, Saccharine sodique, Silice colloïdale anhydre, Sodium, Sodium cyclamate
Contre-indications
Ce médicament ne doit pas être utilisé dans les cas suivants :
— excès de calcium dans le sang ou dans les urines,
— calculs des voies urinaires contenant du calcium,
— immobilisation prolongée (attendre la reprise de la marche pour débuter le traitement),
— phénylcétonurie (comprimé : présence d’aspartam).
Ce produit est un médicament
Retrouvez toutes les informations concernant la notice d'utilisation et la composition du produit.
Le médicament n’est pas un produit comme les autres, lisez attentivement la notice avant de le commander.
La notice détaille toutes les informations relatives aux précautions d’emploi (interactions médicamenteuses, contre-indications, mises en garde spéciales, effets indésirables, …) ainsi que la posologie.
Si les symptômes persistent, s’ils s’aggravent ou si de nouveaux symptômes apparaissent, demande l’avis de votre médecin ou de votre pharmacien.
Pour déclarer un effet indésirable, cliquez ici
Telecharger PDF
Le médicament n’est pas un produit comme les autres, lisez attentivement la notice avant de le commander.
La notice détaille toutes les informations relatives aux précautions d’emploi (interactions médicamenteuses, contre-indications, mises en garde spéciales, effets indésirables, …) ainsi que la posologie.
Si les symptômes persistent, s’ils s’aggravent ou si de nouveaux symptômes apparaissent, demande l’avis de votre médecin ou de votre pharmacien.
Pour déclarer un effet indésirable, cliquez ici
Fiche Info
Date de l'autorisation : 27/03/1995
Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.
Pour plus d'information sur les pictogrammes, consultez .
Indications thérapeutiques
CACIT VITAMINE D3 contient deux substances actives, le carbonate de calcium et le cholécalciférol (vitamine D3).
Ce médicament est utilisé chez les personnes âgées pour le traitement des carences en calcium et en vitamine D. Il est également utilisé en association avec des traitements de l'ostéoporose chez les patients carencés ou à haut risque de carence en vitamine D et en calcium.
Groupe(s) générique(s)
Ce médicament n'appartient à aucun groupe générique
Composition en substances actives
-
 Granulés (Composition pour un sachet de 8 g)
Granulés (Composition pour un sachet de 8 g)
-
> calcium élément
 1000 mg
1000 mg
-
 sous forme de : carbonate de calcium
sous forme de : carbonate de calcium  2500 mg
2500 mg
-
-
> vitamine D3
 22 microgrammes
22 microgrammes
-
 sous forme de : concentrat de cholécalciférol, forme pulvérulente
sous forme de : concentrat de cholécalciférol, forme pulvérulente  880 UI
880 UI
-
-
> calcium élément
Présentations
> 30 sachet(s) papier aluminium polyéthylène de 8 g
Code CIP : 338 787-3 ou 34009 338 787 3 3Déclaration de commercialisation : 19/09/1995
Cette présentation est
En pharmacie de ville : Prix hors honoraire de dispensation : 5,29 € : 1,02 € Prix honoraire compris : 6,31 €
Taux de remboursement : 65%
Taux de remboursement : 65%
> 90 (3 boites de 30) sachet(s) papier aluminium polyéthylène de 8 g
Code CIP : 372 410-6 ou 34009 372 410 6 9Déclaration de commercialisation : 15/06/2006
Cette présentation est
En pharmacie de ville : Prix hors honoraire de dispensation : 14,98 € : 2,76 € Prix honoraire compris : 17,74 €
Taux de remboursement : 65%
Taux de remboursement : 65%
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS (). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 11/01/2017 | Renouvellement d'inscription (CT) | Le service médical rendu par CACIT VITAMINE D3 reste important dans les indications de l’AMM. |
| Important | Avis du 11/01/2017 | Renouvellement d'inscription (CT) | Le service médical rendu par CACIT VITAMINE D3 reste important dans les indications de l’AMM. |
| Important | Avis du 11/01/2017 | Renouvellement d'inscription (CT) | Le service médical rendu par CACIT VITAMINE D3 reste important dans les indications de l’AMM. |
Pas d'ASMR disponible pour ce médicament ()
- Titulaire de l'autorisation : THERAMEX IRELAND LIMITED
- Conditions de prescription et de délivrance : Aucune
- Statut de l'autorisation : Valide
- Type de procédure : Procédure de reconnaissance mutuelle
- Code CIS : 6 638 550 4
RCP
ANSM - Mis à jour le : 15/11/2022
CACIT VITAMINE D3 1000 mg/880 UI, granulés effervescents pour solution buvable en sachet
Carbonate de calcium .................................................................................................... 2500,00 mg
soit 25 mmol
Cholécalciférol concentré sous forme de poudre .................................................................... 880 UI
Quantité correspondant en cholécalciférol (Vitamine D3) ........................................................... 22 µg
Pour un sachet de 8 g.
Excipients à effet notoire
Chaque sachet contient 163 mg de potassium, 1,1 mg de sorbitol et 1,7 mg de saccharose.
Pour la liste complète des excipients, voir rubrique 6.1.
Granulés effervescents.
Granulés blancs effervescents pour solution buvable.
Correction des carences vitamino-calciques chez les sujets âgés.
Apport vitamino-calcique associé aux traitements spécifiques de l'ostéoporose, chez les patients carencés ou à haut risque de carence vitamino D-calcique.
Posologie
Un sachet par jour.
Mode d’administration
Voie orale.
Verser le contenu du sachet dans un verre, ajouter une grande quantité d’eau, agiter, puis boire immédiatement la solution obtenue.
· Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1.
· Pathologies et/ou conditions entraînant une hypercalcémie et/ou une hypercalciurie.
· Lithiase rénale.
· Hypervitaminose D.
L'apport en calcium et en alcalins provenant d'autres sources (aliments, compléments alimentaires ou autres médicaments) doit être surveillé lorsque le carbonate de calcium est prescrit. Lorsque des doses élevées de calcium sont administrées avec des substances alcalines telles que le carbonate, il existe un risque de syndrome de Burnett (voir rubriques 4.8 et 4.9). La calcémie doit être surveillée lors de l’administration de doses élevées de carbonate de calcium.
En cas de traitement de longue durée, il est justifié de contrôler la calcémie et la fonction rénale par dosage de la créatinine sérique. Cette surveillance est surtout importante chez les patients âgés en cas de traitement associé à base de digitaliques ou diurétiques (voir rubrique 4.5) et chez les patients fréquemment sujets à la formation de calculs. En présence d'une hypercalcémie ou de signes d’altération de la fonction rénale, le traitement par CACIT VITAMINE D3 doit être interrompu.
La vitamine D3 doit être utilisée avec précaution chez les patients présentant une altération de la fonction rénale avec surveillance du bilan phosphocalcique. Le risque de calcification des tissus mous doit être pris en considération. Chez les patients présentant une insuffisance rénale grave, la vitamine D sous forme de cholécalciférol n'est pas métabolisée normalement et d'autres formes de la vitamine D doivent être utilisées ().
CACIT VITAMINE D3 doit être utilisé avec prudence chez les patients atteints de sarcoïdose, en raison d'une augmentation possible du métabolisme de la vitamine D en sa forme active. Chez ces patients, il faut surveiller la calcémie et la calciurie.
CACIT VITAMINE D3 doit être utilisé avec prudence chez les patients immobilisés, atteints d'ostéoporose, en raison de l'augmentation du risque d'hypercalcémie.
Tenir compte de la dose de vitamine D3 dans les sachets lors de toute autre prescription de médicaments contenant de la vitamine D. Toute administration supplémentaire de calcium ou de vitamine D se fera sous stricte surveillance médicale. Dans ces cas, il est nécessaire de surveiller fréquemment la calcémie et la calciurie.
CACIT VITAMINE D3 n'est pas destiné à être utilisé chez l'enfant.
CACIT VITAMINE D3 contient du sorbitol, du saccharose, du potassium et du sodium
Ce médicament contient 1,1 mg de sorbitol dans chaque sachet.
Les patients présentant une intolérance au fructose, un syndrome de malabsorption du glucose - galactose ou un déficit en sucrase-isomaltase (maladies héréditaires rares) ne doivent pas prendre ce médicament.
Ce médicament A prendre en compte chez les patients insuffisants rénaux ou chez les patients contrôlant leur apport alimentaire en potassium.
Ce médicament contient moins de 1 mmol de sodium (23 mg) par sachet, c’est-à-dire qu’il est essentiellement « sans sodium ».
Associations faisant l'objet de précautions d’emploi
Digitaliques
L'administration orale de calcium associé à la vitamine D augmente la toxicité des digitaliques (risque de trouble du rythme). Une stricte surveillance clinique, et, s'il y a lieu, un contrôle de l'ECG et de la calcémie sont nécessaires.
Bisphosphonate, fluorure de sodium
Il est conseillé de respecter un délai minimum de deux heures, avant de prendre du calcium (risque de diminution de l'absorption digestive du bisphosphonate et du fluorure de sodium).
Diurétiques thiazidiques
Une surveillance de la calcémie est recommandée (diminution de l'élimination urinaire du calcium).
Phénytoïne, barbituriques
Diminution possible de l'effet de la vitamine D par inhibition de son métabolisme.
Glucocorticoïdes
Diminution possible de l'effet de la vitamine D.
Tétracyclines par voie orale
Il est recommandé de décaler d'au moins trois heures la prise de calcium (les sels de calcium diminuent l'absorption des tétracyclines).
Aliments
Possibilité d'interactions avec des aliments (par exemple contenant de l'acide oxalique, des phosphates ou de l'acide phytique).
Fer, zinc et strontium
Les sels de calcium peuvent diminuer l'absorption du fer, du zinc et du ranélate de strontium. Par conséquent, les préparations à base de fer, zinc ou ranélate de strontium doivent être prises au moins deux heures avant ou après le calcium/cholécalciférol.
Du fait du dosage élevé en vitamine D3, ce produit n’est pas indiqué pendant la grossesse et l’allaitement.
Pendant la grossesse, le surdosage en cholécalciférol doit être évité :
· des surdosages en vitamine D pendant la gestation ont eu des effets tératogènes chez l'animal ;
· chez la femme enceinte, les surdosages en cholécalciférol doivent être évités car l'hypercalcémie permanente peut entraîner chez l'enfant un retard physique et mental, une sténose aortique supravalvulaire ou une rétinopathie.
Cependant plusieurs enfants sont nés sans malformation après administration de très fortes doses pour une hypoparathyroïdie chez la mère.
La vitamine D et ses métabolites passent dans le lait maternel.
Aucun effet connu, ni attendu.
Les effets indésirables sont répertoriés ci-dessous, par classes de systèmes d'organes et par fréquence. Les fréquences sont définies comme suit : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1 000) ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Affections du système immunitaire
Fréquence indéterminée : réactions d’hypersensibilité telles que angio-œdème et œdème laryngé.
Troubles du métabolisme et de la nutrition
Peu fréquent : hypercalcémie et hypercalciurie.
Fréquence indéterminée : syndrome de Burnett qui est associé à une hypercalcémie, une alcalose et une insuffisance rénale (voir rubriques 4.4 et 4.9).
Affections gastro-intestinales
Rare : constipation, flatulence, nausées, douleurs abdominales et diarrhée.
Affections de la peau et du tissu sous-cutané
Rare : prurit, éruption cutanée et urticaire.
Populations particulières
Chez les patients insuffisants rénaux : risque potentiel d’hyperphosphatémie, de néphrolithiase et de néphrocalcinose (voir rubrique 4.4).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv..
En cas de surdosage, il existe un risque de syndrome de Burnett (voir rubriques 4.4 et 4.8).
Le surdosage se traduit par une hypercalciurie et une hypercalcémie dont les symptômes sont les suivants : nausées, vomissements, polydipsie, polyurie, constipation.
Un surdosage chronique peut provoquer des calcifications vasculaires et tissulaires en raison de l'hypercalcémie.
Traitement
Arrêt de tout apport calcique et vitaminique D, réhydratation.
Classe pharmacothérapeutique : Calcium, associations avec de la vitamine D et/ou d’autres médicaments, code ATC : A12AX.
La vitamine D corrige l'insuffisance d'apport en vitamine D.
Elle augmente l'absorption intestinale du calcium et sa fixation sur le tissu ostéoïde.
L'apport de calcium corrige la carence calcique alimentaire.
Les besoins chez les personnes âgées sont estimés à 1500 mg/jour de calcium élément et 500-1000 UI/jour de vitamine D.
La vitamine D et le calcium corrigent l'hyperparathyroïdie sénile secondaire.
Une étude de 18 mois, en double-aveugle et contrôlée contre placebo, menée chez 3 270 femmes vivant dans des centres de soins, âgées de 84 ± 6 ans recevant un supplément de cholécalciférol (800 UI/jour) et du calcium (1,2 g/jour), a montré une diminution significative de la sécrétion de PTH. Après 18 mois, d'après une analyse « en intention de traiter » (ITT) il a été observé 80 fractures de la hanche (5,7 %) dans le groupe calcium-vitamine D et 110 fractures de la hanche (7,9 %) dans le groupe placebo (p = 0,004). Par conséquent, dans ces conditions d’étude, le traitement a permis d’empêcher la survenue de 30 fractures de la hanche chez 1 387 femmes. Dans une étude de suivi après 36 mois, 137 femmes ont présenté au moins une fracture de la hanche (11,6 %) dans le groupe calcium-vitamine D (n = 1 176) contre 178 femmes (15,8 %) dans le groupe placebo (n = 1 127) (p ≤ 0,02).
Durant la dissolution, le sel de calcium contenu dans CACIT VITAMINE D3 se transforme en citrate de calcium et la quantité de calcium absorbée par le tractus gastro-intestinal est de l'ordre de 30 % à 40 % de la dose ingérée.
Le calcium est éliminé par les fèces, l'urine et les sécrétions sudorales.
La vitamine D est facilement absorbée par l'intestin grêle. Le cholécalciférol et ses métabolites circulent dans le sang, liés à une protéine spécifique. Le cholécalciférol est métabolisé dans le foie par hydroxylation (première hydroxylation) puis ensuite métabolisé dans les reins (deuxième hydroxylation).
La vitamine D, qui n'est pas métabolisée, est stockée dans les tissus adipeux et musculaires. Sa demi-vie plasmatique est de l'ordre de quelques jours. La vitamine D est excrétée via les fèces et l'urine.
Sans objet.
Acide citrique, acide malique, gluconolactone, maltodextrine, cyclamate de sodium, saccharine sodique, arôme citron (contenant : sorbitol),
.
Sans objet.
3 ans.
A conserver à une température ne dépassant pas 25 °C.
8 g en sachet (Papier/Aluminium/PE). Boîte de 10 (pour échantillons), 20, 30, 46, 50 ou 100 sachets et conditionnement multiple de 90 (3 boites de 30) sachets.
Toutes les présentations peuvent ne pas être commercialisées.
Verser le contenu du sachet dans un verre, ajouter une grande quantité d’eau, remuer, puis boire immédiatement la solution obtenue.
THERAMEX IRELAND LIMITED
3RD FLOOR, KILMORE HOUSE
PARK LANE, SPENCER DOCK
DUBLIN 1, D01YE64,
IRLANDE
· 34009 338 787 3 3 : 8 g en sachet (Papier/Aluminium/PE). Boîte de 30.
· 34009 372 410 6 9 : 8 g en sachet (Papier/Aluminium/PE). Boîte de 90 (3 boites de 30).
· 34009 558 679 5 1 : 8 g en sachet (Papier/Aluminium/PE). Boîte de 100.
[à compléter ultérieurement par le titulaire]
[à compléter ultérieurement par le titulaire]
Sans objet.
Sans objet.
Médicament non soumis à prescription médicale.
Notice
ANSM - Mis à jour le : 15/11/2022
CACIT VITAMINE D3 1000 mg/880 UI, granulés effervescents pour solution buvable en sachet
Carbonate de calcium/cholécalciférol
Veuillez lire attentivement cette notice avant de prendre ce médicament car elle contient des informations importantes pour vous.
Vous devez toujours prendre ce médicament en suivant scrupuleusement les informations fournies dans cette notice ou par votre médecin, votre pharmacien ou votre infirmier/ère.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Adressez-vous à votre pharmacien pour tout conseil ou information.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
· Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien.
1. Qu'est-ce que CACIT VITAMINE D3 1000 mg/880 UI, granulés effervescents pour solution buvable en sachet et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre CACIT VITAMINE D3 1000 mg/880 UI, granulés effervescents pour solution buvable en sachet ?
3. Comment prendre CACIT VITAMINE D3 1000 mg/880 UI, granulés effervescents pour solution buvable en sachet ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver CACIT VITAMINE D3 1000 mg/880 UI, granulés effervescents pour solution buvable en sachet ?
6. Contenu de l’emballage et autres informations.
CACIT VITAMINE D3 contient deux substances actives, le carbonate de calcium et le cholécalciférol (vitamine D3).
Ce médicament est utilisé chez les personnes âgées pour le traitement des carences en calcium et en vitamine D. Il est également utilisé en association avec des traitements de l'ostéoporose chez les patients carencés ou à haut risque de carence en vitamine D et en calcium.
Ne prenez jamais CACIT VITAMINE D3 1000 mg/880 UI, granulés effervescents pour solution buvable en sachet :
· si vous êtes allergique aux substances actives ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6,
· si vous avez une maladie et/ou pathologie ayant entraîné des taux élevés de calcium dans vos urines (hypercalciurie) ou dans votre sang (hypercalcémie),
· si vous avez des calculs rénaux,
· si vous avez des taux élevés de vitamine D dans le sang (hypervitaminose D).
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant de prendre CACIT VITAMINE D3 :
· si votre fonction rénale est altérée ou si vous êtes sujet à la formation de calculs rénaux. Si vos reins ne fonctionnent pas correctement, votre traitement devra être étroitement surveillé afin de s'assurer que le calcium ne s'accumule pas dans votre sang,
· si vous avez une sarcoïdose (une maladie inflammatoire d’origine non identifiée qui se caractérise par la formation de grosseurs à différents endroits),
· si vous êtes un patient immobilisé atteint d’ostéoporose.
Si vous êtes sous traitement prolongé, il est possible que votre médecin veuille vérifier, de temps en temps, le taux de calcium dans votre sang et prélever des échantillons d’urines afin de surveiller la fonction rénale. En fonction des résultats, votre médecin pourra réduire la dose ou décider d’interrompre le traitement.
Enfants et adolescents
CACIT VITAMINE D3 n’est pas destiné à être utilisé chez les enfants.
Autres médicaments et CACIT VITAMINE D3 1000 mg/880 UI, granulés effervescents pour solution buvable en sachet
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Consultez votre médecin si vous prenez l’un des médicaments suivants :
· médicaments pour le cœur tels que digoxine ou autres digitaliques,
· biphosphonates ou du fluorure de sodium (médicaments utilisés pour traiter les problèmes osseux),
· diurétiques thiazidiques,
· phénytoïne ou barbituriques (médicaments utilisés pour traiter l’épilepsie),
· glucocorticoïdes,
· antibiotiques tétracyclines,
· autres médicaments contenant de la vitamine D ou du calcium.
Les sels de calcium peuvent diminuer l'absorption du fer, du zinc et du ranélate de strontium. Par conséquent, les préparations à base de fer, zinc ou ranélate de strontium doivent être prises au moins deux heures avant ou après CACIT VITAMINE D3.
CACIT VITAMINE D3 1000 mg/880 UI, granulés effervescents pour solution buvable en sachet avec des aliments, boissons et de l’alcool
Ce médicament peut interagir avec certains aliments contenant de l'acide oxalique (par exemple, épinards et rhubarbe), des phosphates (par exemple, son de blé) ou de l'acide phytique (par exemple, céréales complètes) car ils peuvent réduire l’absorption du calcium contenu dans CACIT VITAMINE D3.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Du fait de la quantité de vitamine D, ce produit n’est pas indiqué pendant la grossesse et l’allaitement. Chez les femmes enceintes, des surdosages en calcium et vitamine D doivent être évités compte tenu du fait qu’une hypercalcémie permanente peut avoir des effets néfastes sur le fœtus en développement.
CACIT VITAMINE D3 peut être utilisé pendant l’allaitement mais votre médecin doit en être informé car le calcium et la vitamine D sont excrétés dans le lait maternel. Ceci est à prendre en compte en cas d’administration complémentaire de vitamine D à l’enfant.
Conduite de véhicules et utilisation de machines
CACIT VITAMINE D3 n’est pas susceptible d’affecter votre aptitude à conduire des véhicules et à utiliser des machines
CACIT VITAMINE D3 1000 mg/880 UI, granulés effervescents pour solution buvable en sachet contient du potassium, du sodium, du sorbitol et du saccharose
· Ce médicament contient (163 mg) dans chaque sachet. Ceci est à prendre en compte pour les malades souffrant d'une insuffisance rénale ou sous régime potassique contrôlé.
· Ce médicament contient moins de 1 mmol (23 mg) de sodium par sachet, c’est-à-dire qu’il est essentiellement « sans sodium ».
· CACIT VITAMINE D3 contient 1,1 mg de sorbitol dans chaque sachet.
· Si votre médecin vous a informé(e) d’une intolérance à certains sucres, contactez-le avant de prendre ce médicament.
Veillez à toujours prendre ce médicament en suivant exactement les instructions de cette notice ou les indications de votre médecin, pharmacien ou infirmier/ère. Vérifiez auprès de votre médecin, pharmacien ou infirmier/ère en cas de doute.
Adultes
Versez le contenu du sachet dans un verre, ajoutez une grande quantité d'eau, remuez, puis buvez immédiatement après l’arrêt du pétillement. La dose recommandée est de un sachet par jour.
Votre médecin ou votre pharmacien vous indiquera combien de sachets vous devez prendre par jour.
Si vous avez pris plus de CACIT VITAMINE D3 1000 mg/880 UI, granulés effervescents pour solution buvable en sachet que vous n’auriez dû
Lors de la prise d'une dose excessive de ce traitement, les symptômes suivants peuvent apparaître : nausées, vomissements, soif intense, besoin d’uriner plus fréquent, constipation. Si de tels effets se manifestent, prévenez immédiatement votre médecin qui prendra les mesures nécessaires.
En cas de surdosage prolongé, des calcifications peuvent apparaître dans les vaisseaux ou les tissus.
Si vous oubliez de prendre CACIT VITAMINE D3 1000 mg/880 UI, granulés effervescents pour solution buvable en sachet
Ne prenez pas de dose double pour compenser la dose que vous avez oubliée de prendre.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde.
Vous pouvez présenter une réaction allergique. Si vous présentez une éruption cutanée, des démangeaisons, des difficultés à respirer ou un gonflement du visage, des lèvres, de la gorge ou de la langue, arrêtez immédiatement de prendre ce médicament et consultez un médecin sans attendre.
Peu fréquent (pouvant affecter jusqu’à 1 personne sur 100) :
· forte concentration de calcium dans le sang (hypercalcémie). Les symptômes incluent nausées, vomissements, manque d’appétit, constipation, maux de ventre, douleurs osseuses, soif intense, besoin d’uriner plus fréquent, faiblesse musculaire, somnolence et confusion ;
· augmentation de la teneur en calcium dans les urines (hypercalciurie).
Rare (pouvant affecter jusqu’à 1 personne sur 1 000) :
· constipation, flatulences, nausées, douleurs abdominales, diarrhée ;
· démangeaisons, éruption cutanée et urticaire.
Fréquence indéterminée (ne peut être estimée sur la base des données disponibles)
· syndrome de Burnett qui est associé à une concentration élevée de calcium dans le sang (hypercalcémie), une élévation du pH sanguin (alcalose) et une insuffisance rénale.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : .En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
Tenir ce médicament hors de la vue et de la portée des enfants.
A conserver à une température ne dépassant pas 25 °C.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
· Les substances actives sont :
Carbonate de calcium............................................................................................... 2500,00 mg
Quantité correspondant à calcium élément ............................................ 1000,00 mg soit 25 mmol
Cholécalciférol concentré sous forme de poudre.............................................................. 880 UI
Quantité correspondant en cholécalciférol (Vitamine D3)..................................................... 22 µg
Pour un sachet de 8 g.
Les autres composants sont : acide citrique, acide malique, gluconolactone, maltodextrine, cyclamate de sodium, saccharine sodique, arôme citron (contenant : sorbitol), amidon de riz, carbonate de potassium, ascorbate de sodium, tout-rac-alpha-tocophérol, , amidon modifié, saccharose, triglycérides à chaine moyenne, et silice colloidal anhydre..
8 g en sachet (Papier/Aluminium/PE). Boîte de 10 (pour échantillons), 20, 30, 46, 50 ou 100 sachets et conditionnement multiple de 90 (3 boites de 30) sachets.
Toutes les présentations peuvent ne pas être commercialisées.
THERAMEX IRELAND LIMITED
3RD FLOOR, KILMORE HOUSE
PARK LANE, SPENCER DOCK
DUBLIN 1, D01YE64,
IRLANDE
THERAMEX FRANCE
TOUR ATLANTIQUE
1 PLACE DE LA PYRAMIDE
92911 PARIS LA DÉFENSE CEDEX
HERMES PHARMA Ges M.b.H
SCHWIMMSCHULWEG 1a
9400 WOLFSBERG
AUTRICHE
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Page mise à jour le : 09/09/2024 23:19